こんにちは。田澤です。
昨日みたいに天気がいいと、ジョギングしている人多いですね。
「ジョギングも危ない」みたいな話がありますが…
(私は)すれ違う時には『呼吸を止める」し、なるべく(人から)離れたルートを選択しています。
(幾ら深く呼吸をするからといっても)「パチンコ店」や「ライブ会場」、「バー」での密閉された空間と、野外での開放された空間では比較になりません。

左)amazonに3/26に配達してもらい、この「1か月間」履いたTARTHERZEAL 6
右)amazonで届いた新品
何でもかんでも「可能性が…」みたいにするのはよくありません。(物事の本質を考えましょう)
Trastuzumab Deruxtecan(商品名 エンハーツ)
「掲示板」でoptimist さんからのリクエストがありました。
この薬剤は2つの側面から理解する必要があります。
1.ADC (Antibody-Drug Conugate)として

抗体を標的の精密認識・デリバリー機能を担当する部位として使い、実質的な薬効(抗ガン作用が多い)は低分子医薬に担わせるというコンセプト
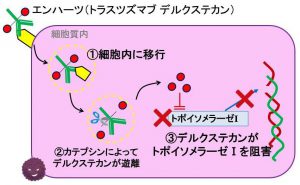
・抗体であるtrastuzumabに(トポイソメラーゼ阻害剤である)deruxtecanをリンカーで接合しており、trastuzumabにより運ばれたderuxtecanがHER2陽性細胞だけで威力を発揮するというイメージです。
・抗HER2薬では、他にtrastuzumab emtansineが同様のコンセプトの薬剤として承認されています。
2.抗HER2薬として
抗HER2薬の「適応拡大」が加速している。
古くはtrastuzumabの適応拡大の歴史があります。
〇 trastuzumab
2001 年6 月1 日 ハーセプチン150mg 発売 (適応症:HER2 過剰発現が確認された転移性乳癌)
2004 年8 月8 日 ハーセプチン60mg 発売 (適応症:同上)
2008 年2月29 日 適応拡大(適応症:HER2 過剰発現が確認された乳癌における術後補助化学療法)
2011年11月25日 適応拡大(適応症:HER2過剰発現が確認された乳癌における術前補助化学療法)

一番大きなインパクトを与えたのが2008です。
これがHER2陽性乳癌の予後を劇的に変えたと言っても過言ではありません。
〇 pertuzumab
2013年6月28日「HER2陽性の手術不能又は再発乳癌」として承認
2018年10月10日 適応拡大(適応症:HER2陽性の乳がん) 術後補助療法として使えるようになりました。
〇 trastuzumab emtansine
2013年9 月20 日 「HER2 陽性の手術不能又は再発乳癌」として承認
2019年8月30日 「HER2陽性の早期乳がんにおける術後薬物療法」に対する適応拡大の承認申請 注 1 )

注 1 ) ただし、この適応申請は海外で実施した非盲検ランダム化第III相国際共同臨床試験(KATHERINE試験)の成績に基づいている。
その試験対象が『ハーセプチンを含む術前薬物療法でpCRが得られなかったHER2陽性早期乳がん患者』で
あるため、適応拡大の対象が(trastuzumabやpertuzumabとは異なり)「ハーセプチンを含む術前薬物療法でpCRが得られなかった人」に限定される公算が高いと言われている。
◎ trastuzumab deruxtecan
2020/3/25日「化学療法歴のあるHER2陽性の手術不能又は再発乳癌(標準的な治療が困難な場合に限る)」として適応承認
5月にも発売か?

ただし、更に条件があります。
・trastuzumab / taxane / trastuzumab emtansineによる治療歴のない患者さんには使用不可
これは、この薬剤が『グローバル第2相臨床試験「DESTINY-Breast01試験」のデータ』に基づいているからです。
DESTINY-Breast01
・治療対象 平均で6つの前治療歴(trastuzumab emtansine(T-DM1), trastuzumab, pertuzumab、その他抗HER2療法、ホルモン療法など)がある184人の患者さんを対象
♯ trastuzumab, T-DM1の投与歴があったのは100% 注 2 )、pertuzumabの投与歴があったのは65.8%、その他の抗HER2療法を受けていたのは54.3%だった。
注 2 )より適応条件に『・trastuzumab / taxane / trastuzumab emtansineによる治療歴のない患者さんには使用不可』が付帯していると考えられます。
・治療成績
主要評価項目である客観的奏効率は60.9%、病勢コントロール率は97.3%、奏効期間中央値は14.8か月、無増悪生存期間中央値は16.4か月、全生存期間中央値は未達

これは「驚くべき」数値です!
first lineでの数値ならまだしも、この臨床試験対象からして「trastuzumab-paclitaxel」及び「trastuzumab-emtansine」投与後で、これだけの数値が出ているのです。
その期待値は米国FDA:Food and Drug Administrationが2019年12月に申請から僅か2か月で承認したことからもうかがい知れます。

スゴイね!
何の問題点も無いの?

間質性肺炎に対する注意が必要なんだ。(死亡例の報告あり)
投与前に「胸部CT]のチェックや諸症状など必須となってます。
現在、「コロナ」で世の中が肺炎に過敏となっていることもあり投与には慎重さが求められています。